عاطف
واحد من الناس


تاريخ التسجيل : 03/08/2009
العمر : 38
الموقع : http://moussiac.blogspot.com
بطاقة الشخصية
الحقول : 2
 |  موضوع: المواد والكهرباء: بنية الذرة Matériaux et électricité : Structure de l’atome موضوع: المواد والكهرباء: بنية الذرة Matériaux et électricité : Structure de l’atome  الثلاثاء يونيو 01, 2010 5:20 am الثلاثاء يونيو 01, 2010 5:20 am | |
|
المواد
والكهرباء: بنية الذرة
Matériaux et électricité : Structure de l’atome
I-) بنية الذرة
1-) تذكير:
- الجزيئة تتكون من ذرات
مرتبطة .
- تتكون المادة انطلاقا من
الذرات.
- رتبة قدر قطر الذرات
تقدر ب 0,1 nanomètre .
- 1g من
الأورانيوم تحتوي على 1020 2,5x
ذرة.
رموز بعض الذرات: | اسم الذرة | الهيدروجين | الكربون | الأزوت | الأوكسجين | الحديد | النحاس | | رمزها | H | C | N | O | Fe | Cu |
2-) تاريخ
الذرة:
- منذ 420 سنة ق.م :
اعتقد(تصور) ديموقريط (Démocrite -460 à -370 ) أن المادة
تتكون من دقائق صغيرة جدا غير قابلة للتجزيء سماها Atomos (في لغة
اليونان تعني الذي لا يتكسر) يعني الذرات.
- في سنة 1805 أعلن جون
دالتونJohn
Dalton وجود الذرات.
- في سنة 1897 اكتشف طومسون J.J Thomson أحد
مكونات الذرة ، سماها لإلكتروات électrons ، و هي دقائق
صغيرة جدا مشحونة بكهرباء سالبة لا ترى بأي مجهر.
- في سنة 1911 اكثشف العالم روذرفوردRutherford
من
تجاربه الجزء المركزي للذرة ويسمى النواة ، مشحون بكهرباء موجبة.
و بعد إنجاز بعض الحسابات وجد أن أغلبية
كتلة الذرة توجد في النواة.
3-) نموذج روذرفورد ( 1871-1937 ) modèle de Rutherford
تتكون الذرة من إلكتروات تدور حول النواة
حسب مسارات دائرية ، يفصل بينهما فراغ.

4-)
النموذج الحالي للذرة.
تتكون الذرة من نواة و سحابة
إلكترونية بها إلكترونات تدور حول النواة بسرعةكبيرة ، مسار و موضع
الإلكترونات غير معروفين. 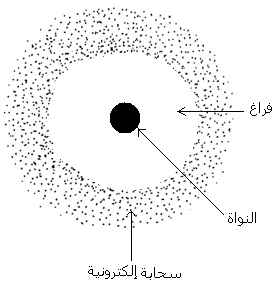
5-)مكونات الذرة
أ-) النواة : le
noyau
النواة هي وسط
الذرة ، مشحونة بكهرباء موجبة،
كتلة النواة تساوي تقريبا كتلة الذرة. كتلة الذرة تقدر
ب k .
10-26 kg
قطر الذرة يقدر ب 0,1nm و قطر النواة يقدر ب 0,000001nm أي 0,1/
0,000001=100000 ;قطر النواة أصغر
من قطر الذرة ب 100 ألف مرة .
إذا مثلت نواة الذرة بكرية قطرها 1cm، على أية مسافة ستمثل الإلكترونات؟
ب -) الإلكترونات: Les
électrons
الإلكترونات دقائق صغيرة جدا تدور حول النواة . كتلة
الإلكترون تساوي 9,109534x10-31 kg
يرمز للإلكترون بالرمز -e .
الشحنة
الكهربائية للإلكترون تساوي - e
e : تسمى الشحنة الابتدائية و هي أصغر
كميةالكهرباء معروفة لحدالآن و تساوي : e= 1,6 x 10-19 C
ِC: الكولوم coulomb هي الوحدة الأساسية لقياس
كمية الكهرباء.
ج-) العدد الذري Numéro
atomique .
هو عدد الإكترونات الموجودة في كل ذرة، يرمز له
بالحرف Z .تتميز
كل ذرة بعدد الكتروناتها. تختلف
كل ذرة عن أخرى باختلاف نواها وعدد إلكتروناتها.
| الذرة | رمزها | العدد الذري | | الهيدروجين | H | Z=1 | | الأزوت | N | Z=7 | | الألومنيوم | Al | Z=13 | | الحديد | Fe | Z=26 | | الذهب | Au | Z=79 |
تمرين1 :
ذرة
النحاس Cu لها
Z=29 . احسب شحنة السحابة الإلكترونية.
تمرين2 :
شحنة
السحابة الإلكترونية لذرة الحديد هي x -41,6 x 10-19 C.علما أن
الشحنة الابتدائية هي e= 1,6 x 10-19 .أوجد العدد الذري لذرة الحديد.
د-) التعادل الكهربائي للذرة
الذرة متعادلة كهربائيا حيث أن الشحنة
الكهربائية السالبة للإلكترونات تعادل الشحنة الموجبة للنواة أي شحنة الذرة
منعدمة(صفر).
عدد الشحنات السالبة يساوي عدد الشحنات الموجبة.
تمرين3 : العدد الذري لذرة الفضة
هو47 .احسب الشحنة الكهربائية لنواة هذه الذرة بدلالة e .
III- ظاهرة
التكهرب
1-)نشاط تجريبي :أ-) التجربة1ب-)
التجربة 2 2-) الملاحظة3-)
التفسير 4-) الاستنتاج
IV- الأيونات Les ions
1-) تعريف:
الأيون هو كل ذرة أو جزيئة(مجموعة من الذرات
المرتبطة) فقدت أو كسبت إلكترونا أو أكثر.
2-) صيغة الأيونات:
أ-)رمز الأيون أحادي الذرة:
يرمز للأيون أحادي الذرة بنفس رمز
الذرة التي ينتج عنها ، و يضاف إلى أس الرمز عددا من
الإشارات (-) أو (+) ، كل إشارة (+) تمثل إلكترونا مفقودا ، وكل إشارة (-)
تمثل إلكترونا مكتسبا.
أمثلة:
ذرة الأوكسجين تفقد إلكترونين ، اكتب رمز أيون الأوكسجين . الجواب
: --O ذرة الكلور Cl تكسب
إلكترونا واحدا ، اكتب رمزأيون الكلورور . الجواب
:-Cl
ذرة
الحديد تفقد تارة إلكترونين و تارة ثلاث ألكترونات ، اكتب رمزأيوني
الحديد. الجواب : ++Fe+++ ;
Fe ،
ب
-) صيغة الأيون متعدد الذرات
إذا كان الأيون متعدد الذرات نكتب صيغته
بكتابة جنبا إلى جنب رموز وعدد الذرات التي تدخل في تركيبه، و يضاف الى أس
الصيغة عدد الإشارات (+) أو (-
). صيغة
أيون الهيدروكسيد هي -OH.
ذصيغة أيون الكبريتات --SO4
ملحوظة : عندما تفقد أو تكتسب
الذرة إلكترونا لايطرأ أي تغير على النواة.الشحنة
التي يحملها الأيون تنتمي إلى مجموع الذرات المكونة للأيون .
ج-) الأيونات الموجودة في الماء المعدني:
تمرين4
ذرة النحاس Cu لها Z=29 .
1-) احسب الشحنةالكهربائية للسحابة الإلكترونية لذرة
النحاس
2 .ذرة النحاس تفقد إلكترونين لتصبح أيونا:
أ-) أوجد عدد إلكترونات أيون النحاس.
ب-) اكتب رمز أيون النحاس .
ج-) أوجد شحنة الأيون بدلالة e .
تمرين5
العدد الذري لذرة الأزوت هو 7 و العدد الذري
لذرة الهيدروجين هو 1.
1-)حدد نوع
وعدد الذرات التي تؤلف أيون الأمونيوم NH4+ .
2-)احسب عدد إلكترونات و شحنة
الأيون + NH4.
التمرين6
محلول الملح يحتوي
على أيونين-Cl و
+Na ، العدد الذري لذرة
الصوديوم هو 11 و الشحنة الكهربائية لنواة أيون الكلورور هي x + 27,2 x 10 -19
C
1-) علما أن e
= 1,6 x 10-19 C ،
احسب قيمة الشحنة الكهربائية لإلكترونات أيون الصوديوم بالكولوم.
2-) أوجد العدد الذري لذرة الكلور.
Un modèle est un "outil" qui permet de prévoir
et d'interpréter certains phénomènes réels
النموذج هو تمثيل و تفسير مبسط للواقع.. | |
|